Technical
| Begriff | Definition |
|---|---|
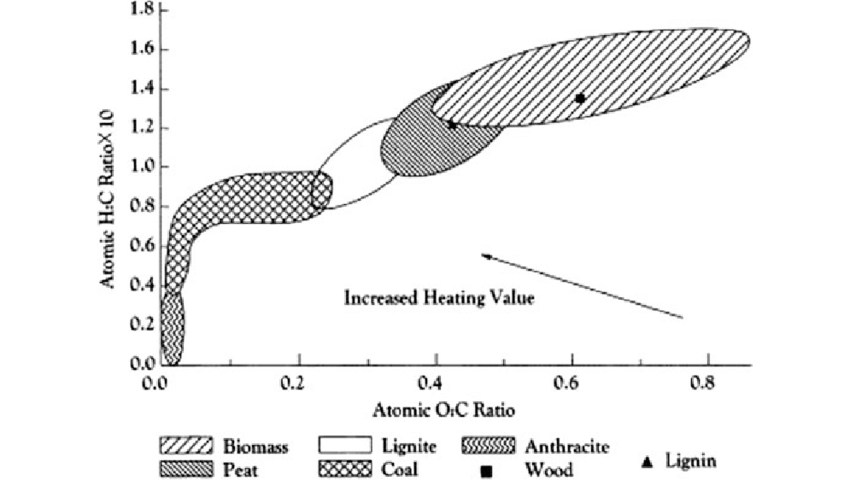
| O/C-H/C-Diagram |
Zugriffe - 1625
|
| Oberflächenbindung | Biokohlen weisen eine große Kapazität zur Sorption, Bindung und Einlagerung von Nährstoffionen sowie anorganischen und organischen Verbindungen auf. Diese resultiert aus ihrer sehr großen inneren und äußeren Oberfläche. Durch Oxidation der Oberflächen entstehen funktionelle Gruppen mit negativem Ladungsüberschuss. Die Sorptionskapazität für Nährstoffkationen wie K+ , Mg2+ oder NH4 + entwickelt sich also in besonderem Maße im Zuge der Alterung frischer Biokohlen oder durch spezielle Maßnahmen bei der Herstellung (z.B. Aktivierung mit Wasserdampf).
Zugriffe - 1608
|
| Oberflächenoxidation | Die Oxidation der Oberflächen frischer Biokohlen im Zuge ihrer Alterung führt zur Bildung einer Vielzahl funktioneller Gruppen, welche ihre Reaktivität bedingen (Hammes und Schmidt 2009). Im Allgemeinen handelt es sich um Carboxyl-, Phenol-, Carbonyl-, Hydroxyl- oder Ami-nogruppen. Diese Gruppen bestimmen die chemischen Wirkungen der Kohlen, die sowohl als Katalysator als auch als Reagenz fungieren können. Gleichzeitig nimmt die negative Ladung der Oberflächen zu (Cheng et al. 2006 und 2008a, Hilscher et al. 2009, Liang et al. 2006). Dies führt zu einer Zunahme der Kationenaustauschkapazität. Damit können Nährstoffe in größerem Maße gebunden werden und für Pflanzen und Mikroorganismen über einen längeren Zeit-raum verfügbar bleiben. Aufgrund ihrer Polarität wirken sich hydrophile Gruppen (amino, carboxyl, keto …) auch auf die Wasserhaltekapazität des Bodens aus (Sevilla et al. 2011, Spokas et al. 2012a) und erhöhen die Wasserlöslichkeit und den Transport der Biokohlen mit dem Si-cker- und Oberflächenwasser (Glaser et al. 2002a, Hilscher und Knicker 2011, Rumpel et al. 2006a, Wiesmeier et al. 2009). Neben den organischen Verbindungen enthalten die Biokohlen auch anorganische Verbindun-gen, die in ihrer Gesamtheit als „Asche“ bezeichnet werden. Hierzu zählen metallische Oxide wie Al2O3, CaO, MgO, MnO2, Fe2O3, Na2O, oder K2O und nichtmetallische Oxide wie SiO2, SO3 und P2O5 (Brewer et al. 2009), die leicht ausgewaschen werden können (Yao et al. 2010).
Zugriffe - 1539
|
| Oelverschmutzung | Oil spills cause massive loss of aquatic life. Oil spill cleanup can be very expensive, have secondary environmental impacts, or be difficult to implement. This study employed five different adsorbents: (1) commercially available byproduct Douglas fir biochar (BC) (SA ∼ 695 m2/g, pore volume ∼ 0.26 cm3/g, and pore diameter ∼ 13–19.5 Å); (2) BC modified with lauric acid (LBC); (3) iron oxide-modified biochar (MBC); (4) LBC modified with iron oxide (LMBC); and (5) MBC modified with lauric acid (MLBC) for oil recovery. Transmission, engine, machine, and crude oils were used to simulate oil spills and perform adsorption experiments. All five adsorbents adsorbed large quantities of each oil in fresh and simulated seawater with only a slight pH dependence, fast kinetics (sorptive equilibrium reached before 15 min), and high regression fits to the pseudo-second-order kinetic model. The Sips isotherm model oil sorption capacities for these sorbents were in the range ∼3–11 g oil/1 g adsorbent. Lauric acid-decorated (60–2 wt %) biochars gave higher oil adsorption capacities than the undecorated biochar. Lauric acid enhances biochar hydrophobicity and its water contact angle and reduces water influx into biochar’s porosity preventing it from sinking in water for 3 weeks. These features were observed even at 2% wt of lauric acid (sinks only after 2 weeks). Magnetization by magnetite nanoparticle deposition onto BC and LBC allows the recovery of the exhausted adsorbent by a magnetic field as an alternative to filtration. Oil sorption was endothermic. Recycling was demonstrated after toluene stripping. The oil-laden adsorbents’ heating values were obtained, suggesting an alternative use of these spent adsorbents as a low-cost fuel after recovery, avoiding waste disposal costs. The initial and oil-laden adsorbents were characterized by scanning electron microscopy, transmission electron microscopy, energy-dispersive X-ray spectroscopy, Fourier transform infrared spectroscopy, X-ray diffraction, Brunauer–Emmet–Teller surface area, contact angle, thermogravimetric analyses, differential scanning calorimetry, vibrating sample magnetometry, elemental analysis, and X-ray photoelectron spectroscopy.
Zugriffe - 1649
|
| Organische Verbindungen | Molekulare Verbindungen, in denen Kohlenstoff in Verbindung mit Wasserstoff enthalten ist, werden als „organisch“ bezeichnet. Sie bilden den weitaus größten Teil aller chemischen Verbindungen und leiten sich vom Methangas, der Gruppe der Alkane bzw. den Kohlenwasserstoffen ab. Im Kohlenwasserstoffgerüst organischer Verbindungen befinden sich oft weitere Atomgruppen, die die Eigenschaften der organischen Verbindung beeinflussen. Dem Kohlenstoffgerüst entsprechend werden organische Verbindungen unterteilt in:
Zugriffe - 1608
|
| Oxdiation | Eine Oxidation ist eine chemische Reaktion, bei der ein Stoff eine bestimmte Anzahl von Elektronen abgibt. Dabei wird der Stoff oxidiert. Du nennst ihn Elektronendonator. Ein anderer Stoff, der Elektronenakzeptor genannt wird, nimmt die Elektronen auf und wird dabei reduziert. Beide Teilreaktionen laufen immer zusammen ab. Du bezeichnest das als Redoxreaktion .
Zugriffe - 1588
|
| Oxonium | Oxonium (auch: Oxonium-Ion, veraltet, aber verbreitet: Hydroxonium und Hydronium, nach IUPAC streng systematisch, aber ungebräuchlich: Oxidanium[1]) ist die Bezeichnung für ein protoniertes Wassermolekül (H3O+). In der Regel werden auch hydratisierte Ionen wie H9O4+ (H3O+ · 3 H2O) als Oxonium- oder Hydroxonium-Ionen bezeichnet. Ladungsträger ist im Wesentlichen das Sauerstoffatom und es handelt sich um ein Kation, was sich aus dem Wort Oxonium ableiten lässt, da Ox(o)... für Sauerstoffatom und ...onium für ein Kation[2] steht. Oxonium bildet sich durch protolytische Reaktionen in Wasser bzw. in wässrigen Lösungen. Im weiteren Sinn sind Oxonium-Ionen eine Sammelbezeichnung für organische Abkömmlinge des Ions H3O+ in der Form [R−OH2]+ [R2OH]+ [R3O]+, wobei R für organische Reste steht.[3][4] Auch bei diesen Kationen tragen Sauerstoffatome die Ladung. Liegen Oxonium (H3O+) oder seine organischen Abkömmlinge als Kation eines Salzes vor, zählt man die Verbindungen zu den Oxoniumsalzen. Liegt Hydronium (auch: Hydronium-Ion) als hydratisiertes H+-Teilchen vor, werden oft aus Gewohnheit bzw. aus Bequemlichkeit die Bezeichnungen H+, H+aq oder H+ · H2O gewählt. Gemeint sind jedoch in der Regel H3O+-Teilchen. Die Bezeichnung Hydronium und das Teilchen H+ sind für die Formulierung von chemischen Reaktionen nur wenig geeignet, da ein Hydron (das H+-Teilchen, auch Proton genannt) in freier Form in Lösungen oder in Verbindungen nicht existiert, sondern sich sofort mit dem nächstbesten Molekül verbindet und daher allein weder Reaktant noch Produkt einer Reaktion ist.
Zugriffe - 1597
|